CHAPITRE 18
Modèles ondulatoire et particulaire de la lumière
Accueil > Physique-Chimie Première > Chapitre 18 - Modèles ondulatoire et particulaire de la lumière - fiche de cours
- Plan
- Définitions
- Formules
- Valeurs
- En pratique
1 Le modèle ondulatoire de la lumière
1
ALe rayonnement et l’onde électromagnétique
A
-
Le modèle ondulatoire de la lumière explique les phénomènes de diffraction et d'interférences observés lors de la propagation d'énergie lumineuse.
- Christian Huygens initie la théorie ondulatoire en 1678.
- James Maxwell affine le modèle et prédit l’existence et la célérité de l’onde électromagnétique en 1865.
- Une onde électromagnétique (OEM) :
❯ est un phénomène vibratoire qui se propage dans le vide et de nombreux milieux (transparents ou non) ;
❯ est constituée d’un champ électrique et d’un champ magnétique oscillants, orthogonaux entre eux et orthogonaux à la direction de propagation ;
❯ se propage dans le vide à la célérité c=3,00×108 m·s-1.
B Les caractéristiques d’une OEM
B
- Caractéristiques de l'onde électromagnétique monochromatique :
❯ sa longueur d’onde, notée λ (lambda), qui correspond à sa période spatiale. Elle s'exprime en mètre (m) ;
❯ sa fréquence, notée ν (nu) ou f, correspond à l’inverse de la période temporelle T. Elle s’exprime en hertz (Hz). - Longueur d’onde λ et fréquence ν sont reliées dans le vide par : λ=νc.
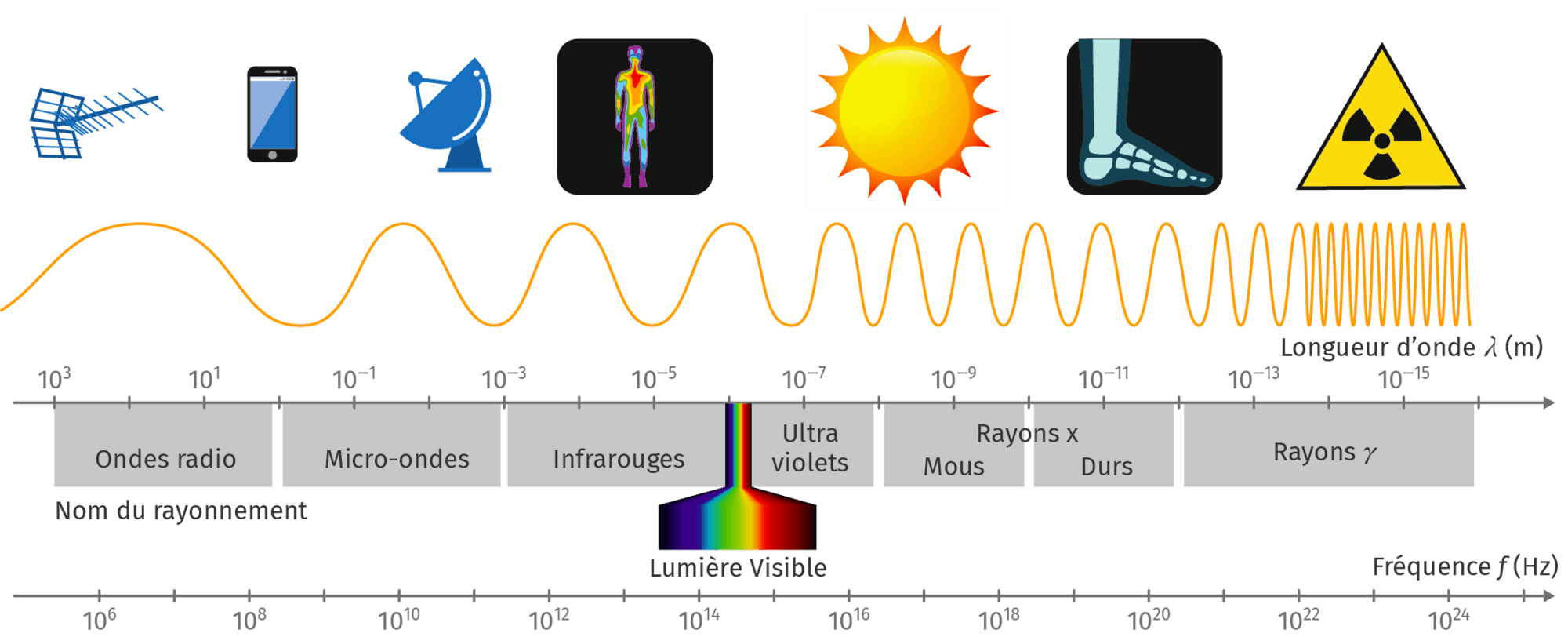
C Le spectre électromagnétique
C
- Les informations perçues visuellement par l'être humain peuvent être limitées.
- Le domaine visible (400 nm < m < 800 nm) n’est qu’une infime partie des ondes électromagnétiques.
- Le spectre électromagnétique est divisé en sept sous-domaines principaux selon les longueurs d'onde : les rayons γ, les rayons X, les ultraviolets, le visible, les infrarouges (proches et lointains), les micro-ondes et les ondes radio.

2 Le modèle particulaire de la lumière
2
A L’imperfection du modèle ondulatoire
A
- Les lois de l'électromagnétisme :
❯ sont formulées par Maxwell au XIXe siècle ;
❯ expliquent de nombreuses observations expérimentales ;
❯ ne permettent pas d’interpréter le rayonnement émis par des corps chauffés ni l’effet photoélectrique. - Le modèle ondulatoire explique :
❯ la propagation de la lumière (OEM) ;
❯ la formation des images ;
❯ est inopérant pour expliquer les interactions d’énergies avec la matière.
B Le photon et son énergie
B
- La quantification de l'énergie de l'onde :
❯ est proposée par Planck en 1900 ;
❯ permet de modéliser les interactions entre la matière et le rayonnement en coïncidence avec l'observation d'un corps noir ;
❯ s'effectue à l'aide d'un paquet d'énergie : le quantum;
❯ c'est la théorie des quanta : tout échange d’énergie avec la matière est un multiple entier de ce minimum d’énergie. - L'effet photoélectrique :
❯ est expliqué par Einstein en 1905 ;
❯ Einstein associe l'idée de quantum à une structure particulaire de la lumière : le photon (une particule de masse et de charge électrique nulles, se déplaçant dans le vide à la vitesse de la lumière) ;
❯ un rayonnement est constitué d’un nombre entier de photons possédant chacun une énergie minimale égale au quantum d’énergie :
Ephoton=h⋅ν.avec :
- Ephoton en joule (J)
- ν la fréquence en hertz (Hz). h
- la constante de Planck : h=6,63×10−34 J·s.
Remarque : l’énergie d’un photon est d’autant plus grande que sa fréquence est élevée et donc que sa longueur d’onde est faible.
3 La quantification des niveaux d’énergie d’un atome
3
A Le diagramme d’énergie d’un atome
A
- Chaque atome possède une structure électronique de couches et sous-couches sur lesquelles se répartissent les électrons.
- Chaque sous-couche associée à une orbite possède sa propre énergie caractéristique.
- On utilise un diagramme énergétique pour représenter les différents niveaux d’énergie intrinsèques à l’atome.
❯ Chaque niveau d'énergie est modélisé par une ligne horizontale. À chaque niveau correspond un état.
❯ On reporte leur valeur d'énergie sur un axe vertical exprimé en électron-volt (eV).
❯ L’énergie de l’atome correspond à la somme des énergies de chaque électron. - Il existe deux types d’états :
❯ l’état fondamental, souvent noté E1 ;
❯ les états supérieurs, dits excités. - L’état ionisé = état limite pour lequel l’électron a quitté l’atome, il correspond au niveau d'énergie E∞=0 eV, tous les autres niveaux ont une énergie négative.
- D’après Niels Bohr (1913), l’atome n’est stable que pour certaines valeurs d’énergie discrètes bien définies. Son énergie est dite quantifiée.
B L’émission et l’absorption d’un photon
B
- Lors d’une transition entre deux niveaux d’énergie, notés En et Em :
❯ l'énergie d'un atome augmente ou diminue, respectivement en absorbant ou en émettant un photon ;
❯ l’énergie échangée ∣ΔE∣ par l’atome possède exactement une valeur égale à la différence des niveaux d’énergie ∣ΔEatome∣=∣En−Em∣ ;
❯ la variation d’énergie de l’atome est égale à l’énergie d’un photon.
Les éléments essentiels de la modélisation
Les éléments essentiels de la modélisation


Les limites de la modélisation
Les limites de la modélisation
-
Il existe deux modèles de description de la lumière : ondulatoire et particulaire. Suivant la situation, on utilise l’un ou l’autre. Il s’agit de la dualité onde-particule.
Le modèle ondulatoire permet d’expliquer :
- la propagation des ondes (seconde) ;
- les phénomènes de réfraction et réflexion de la lumière, les phénomènes de diffraction et d’interférence.
Mais ne permet pas d’expliquer :
- les interactions de faible énergie avec la matière au niveau atomique, comme l’effet photoélectrique.
Le modèle particulaire permet d’expliquer :
- les interactions de faible énergie avec la matière au niveau atomique, comme l’effet photoélectrique.
Mais ne permet pas d’expliquer :
- la propagation des ondes (seconde) ;
- les phénomènes de réfraction et réflexion de la lumière, les phénomènes de diffraction et d’interférence.
Utilisation des cookies
Lors de votre navigation sur ce site, des cookies nécessaires au bon fonctionnement et exemptés de consentement sont déposés.