CHAPITRE 7
Interpréter les propriétés d’une espèce chimique
Accueil > Physique-Chimie Première > Chapitre 7 - Interpréter les propriétés d’une espèce chimique - fiche de cours
- Plan
- Définitions
- Formules
- Valeurs
- En pratique
1 Cohésion dans un solide
1
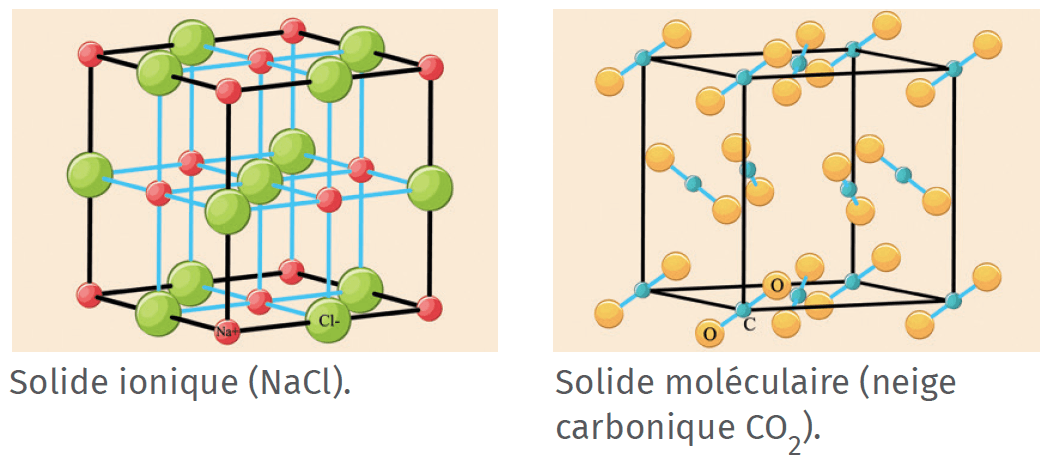
A La cohésion d’un composé solide ionique
A
- Un solide ionique est une structure solide constituée d’un empilement compact et régulier de cations et d’anions en proportions invariables. Leurs interactions électriques permettent la cohésion (stabilité) du solide ionique.
- Deux corps qui portent des charges de même signe se repoussent.
- Deux corps qui portent des charges de signe opposé s’attirent.
- Le solide ionique est électriquement neutre : il contient autant de charges positives que de charges négatives.
- La formule statistique d’un solide ionique rend compte des proportions de cations et d’anions dans le solide, en indiquant d’abord le symbole du cation, puis celui de l’anion, sans la charge électrique
❯ Ex : le cation Na+ et l'anion Cl−forment le solide ionique NaCl(s).
B La cohésion d’un composé solide moléculaire
B
- Un solide moléculaire est une structure constituée d'un empilement compact et régulier de molécules.
- Les Interactions de Van der Waals sont interactions électrostatiques assurant la cohésion des solides moléculaires. À ces interactions de Van der Waals s'ajoutent parfois des liaisons hydrogène.
- Il existe plusieurs types de forces de Van der Waals :
❯ Les interactions entre molécules polaires : les zones qui portent des charges partielles opposées s’attirent ;
❯ Les interactions entre molécules apolaires : le nuage électronique fluctue en permanence donc, à un instant t, une molécule possède une zone chargée positivement et une autre zone chargée négativement. Il peut donc y avoir des interactions électrostatiques entre la zone + d’une molécule et la zone − d’une autre molécule proche.
2Dissolution des solides ioniques dans l’eau
2
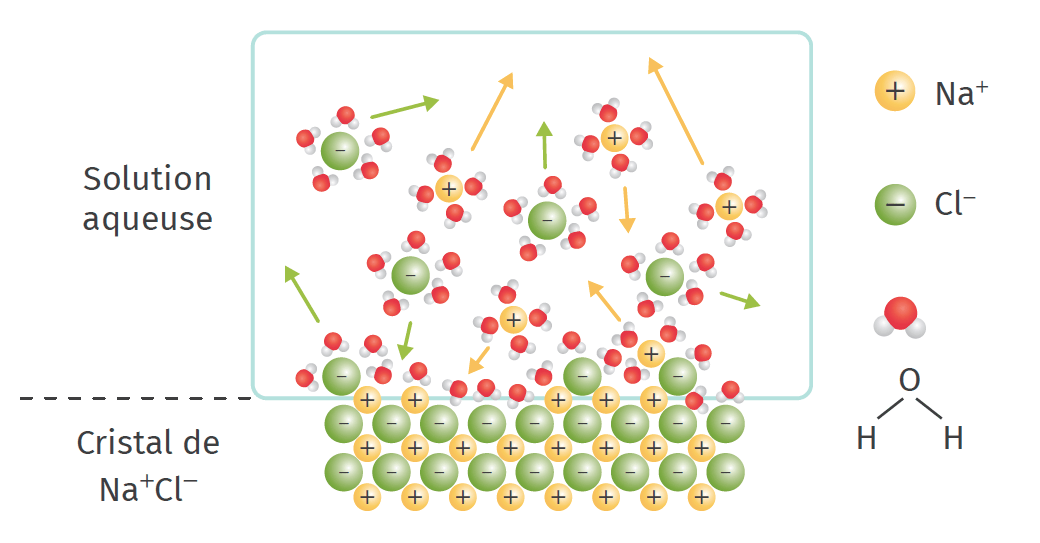
ALes interactions entre l’eau et les ions
A
-
La molécule d’eau est polaire et peut interagir avec les ions du solide ionique entrainant la dissolution d’un solide ionique dans l’eau, qui se déroule en trois étapes :
1. la dissociation du solide ionique : les molécules d’eau s’approchent du solide et fragilisent les interactions électrostatiques qui existent entre les cations et les anions, qui se rompent ;
2. la solvatation : les molécules d’eau entourent les ions : on dit qu’ils sont solvatés ou hydratés ;
3. la dispersion : les ions solvatés s’éloignent du solide et se dispersent parmi les molécules d’eau.
B La modélisation au niveau macroscopique
La dissolution d’un solide ionique AxBy dans l'eau se modélise, au niveau
macroscopique, par une équation de réaction qui s'écrit : B
AxBy(s)⟶eau xAm+(aq)+yBn−(aq).
C Concentration des ions dans une solution
La concentration c en soluté apporté (en mol·L-1) d’une solution est
définie par :
c=VnC
Avec :
- n : quantité de soluté (mol) ;
- c : concentration en soluté apporté (mol·L‑1) ;
- V : volume de la solution (L).
La concentration des ions A+ dans la solution est notée [A+].
3 Extraction par un solvant
3
A Solubilité dans un solvant
A
- La solubilité d’un soluté dans un solvant est sa capacité à se dissoudre dans ce solvant.
- Notée s (exprimée en g·L-1), elle est la masse maximale de cette espèce que l’on peut dissoudre dans 1 litre de solvant, généralement de l’eau.
- La solubilité dépend de :
❯ la température ;
❯ la nature du solvant qui est liée aux interactions entre le soluté et le solvant (plus les interactions sont nombreuses et plus le soluté est soluble dans le solvant).
B Miscibilité de deux liquides
B
- Lorsqu'un soluté est liquide, il peut être soluble dans un solvant, en toutes proportions.
- Les deux liquides sont alors miscibles, ils se mélangent l'un avec l'autre pour former un mélange homogène.
C Extraction par un solvant
C
- L'extraction par un solvant (extraction liquide-liquide) est une technique expérimentale qui permet d’extraire une espèce dissoute dans une solution.
-
Le choix du solvant extracteur dépend de ses propriétés physiques :
- le soluté doit être plus soluble dans le solvant extracteur que dans le solvant initial ;
- le solvant extracteur ne doit pas être miscible avec le solvant initial.
- Pour réaliser l’extraction par solvant, on utilise une ampoule à décanter.
Les éléments essentiels de la modélisation
Les éléments essentiels de la modélisation
- La cohésion d’un solide est assurée par des interactions électrostatiques :
- entre les cations et les anions, pour le solide ionique ;
- entre les molécules polaires ou entre les molécules apolaires (interactions de Van der Waals) et parfois avec des ponts hydrogène, pour le solide moléculaire.
- Au cours de la dissolution d’un solide ionique dans l’eau, le soluté se dissocie et les ions s’entourent de molécules d’eau.
- La solubilité d’un soluté dans un solvant dépend des interactions entre le soluté et le solvant.


Les limites de la modélisation
Les limites de la modélisation
- Les techniques d’extraction liquide-liquide reposent sur les différences de solubilité et de miscibilité entre le soluté et les solvants.
- Cependant, il n’est pas rare qu’un soluté soit soluble dans deux solvants avec des valeurs de solubilité différentes : il faut alors procéder à plusieurs extractions successives.
❯ Si la concentration en soluté est très élevée, les interactions entre le soluté et le solvant sont trop importantes : on ne peut plus définir la concentration en soluté par la simple relation c=Vn.
❯ Pour cette raison, les concentrations usuelles en soluté apporté dépassent rarement 1 mol·L-1.
Utilisation des cookies
Lors de votre navigation sur ce site, des cookies nécessaires au bon fonctionnement et exemptés de consentement sont déposés.