CHAPITRE 2
Composition chimique des solutions
Accueil > Physique-Chimie Première > Chapitre 2 - Composition chimique des solutions - fiche de cours
- Plan
- Définitions
- Formules
- En pratique
1 Espèce colorée en solution
1
A Concentration d’une espèce dissoute
La concentration d’un soluté en solution se calcule en fonction de :A
- sa concentration en masse γ : γ=V solution m solute Avec :
- γ en g·L-1 ;
- la masse msolute, en g ;
- le volume Vsolution de la solution en L.
- sa concentration c en quantité de matière : c=V solution n solute Avec :
- c en mol·L-1 ;
- la quantité de matière nsolute, en mol ;
- le volume Vsolution de la solution en L.
- Remarque : pour un soluté ionique, la concentration en quantité de matière de l’espèce [X]=V solution nX Avec :
- [X] en mol·L-1 ;
- nX en mol ;
- Vsolution en L.
❯ γ=c⋅M, avec M la masse molaire du soluté en g·mol-1.
B Couleur d’une solution
B
- La couleur perçue d’une solution est la couleur complémentaire des radiations absorbées qui traversent la solution.
- Les couleurs complémentaires sont diamétralement opposées sur le cercle chromatique.
C Absorbance
C
- L'absorbance A est la proportion des radiations incidentes d’intensité I0 absorbées en mesurant l’intensité des radiations non absorbées I.
- La courbe A=f(λ) est appelée spectre d'absorption.
Elle permet de déterminer la longueur d’onde, notée λmax, de l’absorbance maximale, notée Amax.
Cette longueur d'onde λmax correspond à la couleur complémentaire de la solution. - Spectrophotomètre = appareil de mesure d’absorbance sur une gamme de longueurs d’onde qui s’étend entre les ultraviolets proches (200 nm à 400 nm) et le domaine visible (400 nm à 800 nm).
2 Dosage spectrophotométrique par étalonnage
2
A Loi de Beer-Lambert
Selon la loi de Beer-Lambert : A
Aλ=ελ⋅l⋅c
avec :
- Aλ, l'absorbance d'une espèce chimique en solution diluée, sans unité ;
- εm, le coefficient d'extinction molaire, en L·mol-1·cm-1 ;
- l, l'épaisseur de la solution, en cm ;
- c, la concentration en quantité de matière, en mol·L-1.
❯ Pour des conditions expérimentales données (λ, ελ et l fixés), la loi de Beer-Lambert peut se résumer à : Aλ=k⋅c, avec k le coefficient de proportionnalité en L·mol-1.
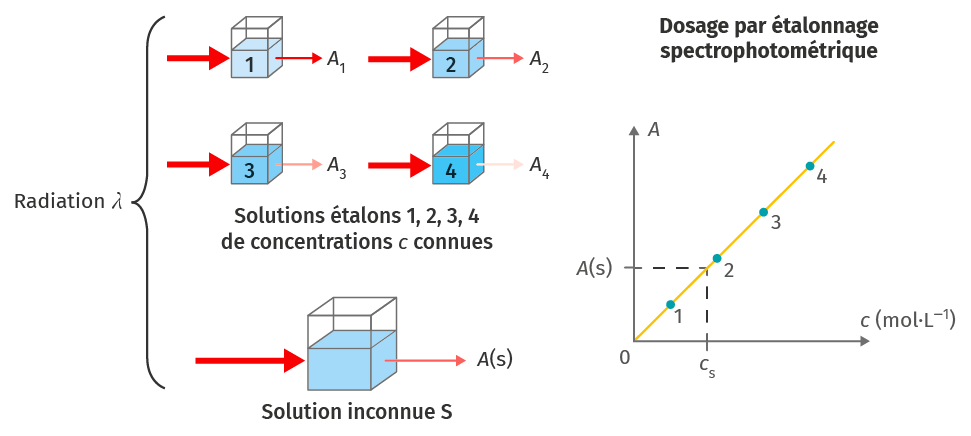
B Dosage spectrophotométrique par étalonnage
Un dosage spectrophotométrique par étalonnage se fait selon le protocole suivant :B
1. Déterminer la longueur d’onde λmax pour laquelle l'absorbance est maximale.
2. Pour λmax, mesurer l’absorbance des solutions étalons et réaliser la droite d’étalonnage représentant la loi de Beer-Lambert, Aλ=k⋅c.
3. Mesurer l’absorbance de la solution colorée à doser et déterminer sa concentration en exploitant la droite d’étalonnage.
Les éléments essentiels de la modélisation
Les éléments essentiels de la modélisation
- Pour une longueur d’onde donnée,l’absorbance d’une espèce chimique colorée en solution est proportionnelle à la concentration de cette espèce chimique.
- La loi de Beer-Lambert s’écrit : Aλ=k⋅c=ελ⋅l⋅c
- Cette propriété permet de doser une espèce chimique par étalonnage spectrophotométrique.

Les limites de la modélisation
Les limites de la modélisation
-
❯ Les conditions de validité de la loi de Beer-Lambert sont les suivantes :
- les espèces chimiques présentes en solution ne doivent pas réagir ensemble ;
- la solution doit être homogène ;
- la radiation incidente doit être monochromatique ;
- la radiation incidente ne doit pas faire réagir les espèces chimiques en solution ;
- les valeurs d’absorbance ne doivent pas être trop importantes : A =1 est la limite communément admise.
Utilisation des cookies
Lors de votre navigation sur ce site, des cookies nécessaires au bon fonctionnement et exemptés de consentement sont déposés.