CHAPITRE 7
Modélisation des transformations physiques
Accueil > Physique-Chimie Seconde > Chapitre 7 - Modélisation des transformations physiques - fiche de cours
- Plan
- Définitions
- Formules
- En pratique
1 Modélisation des transformations physiques
1
A Changement d'état physique
A
- La matière qui nous entoure peut se trouver sous trois états physiques différents : solide, liquide, gaz.
- Lorsque la matière change d’état physique, ses propriétés et l’arrangement spatial de ses molécules sont modifiés.

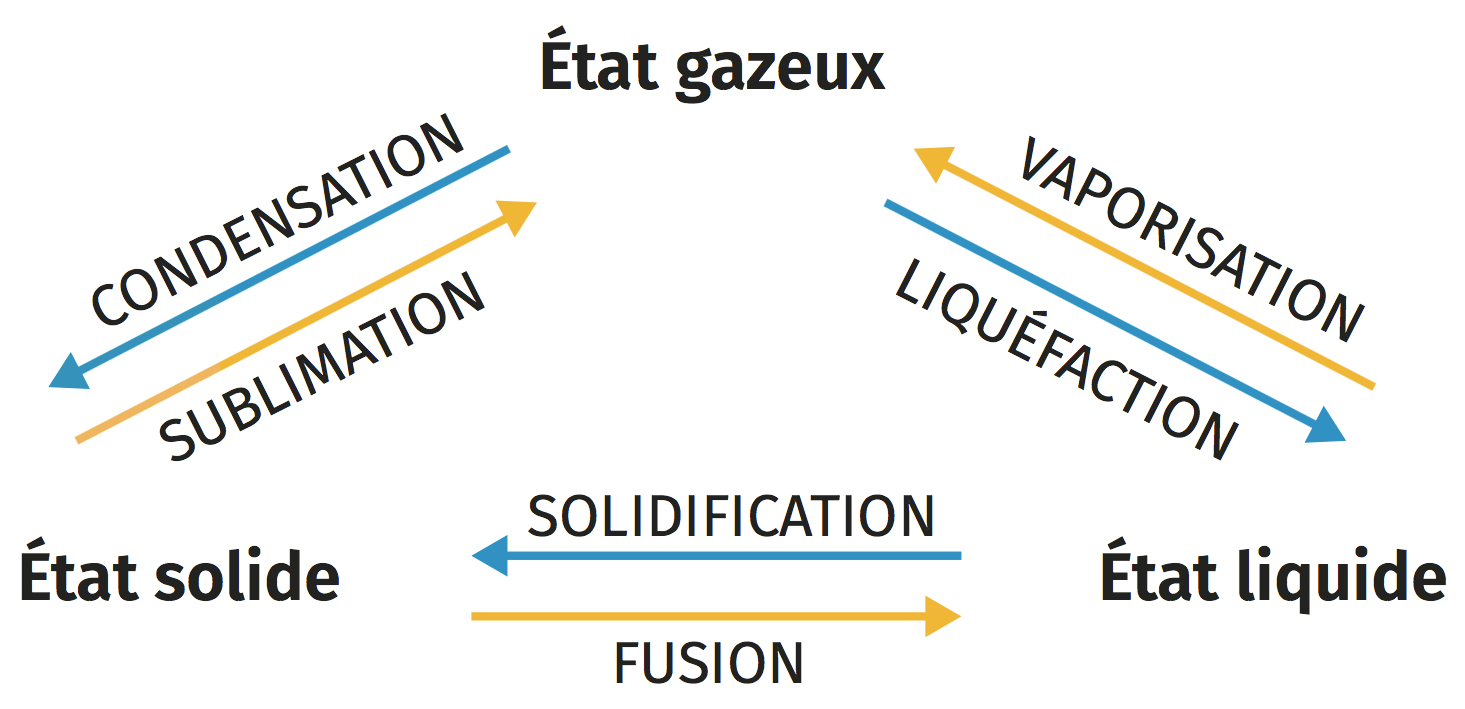
B Écriture symbolique d’un changement d’état
B
- Pour modéliser le changement d’état physique de l'espèce chimique A, on écrit :
A (eˊtat physique 1)→ A (eˊtat physique 2)
C Modélisation microscopique d’un changement d’état
C
- Un gaz : composé d’espèces chimiques libres, sans liaison entre elles, qui se choquent sans cesse.
Dans un gaz, les particules sont agitées et espacées.
- Un liquide : constitué d’espèces chimiques en mouvement, reliées entre elles par des liaisons faibles.
Dans un liquide, les particules sont mobiles et peu liées entre elles. - Un solide : formé d’espèces chimiques fortement liées les unes aux autres, ne disposant que de peu de liberté de mouvement.
Dans un solide, les particules sont quasi immobiles, et liées entre elles.
❯ Un changement d'état entraîne une modification de l'agitation des espèces au niveau microscopique. Les liaisons entre les particules s’affaiblissent, se cassent ou se créent.
2 Les échanges d'énergie
2
A Transformations physiques endothermiques
et exothermiques
A
- Un corps chauffé capte de l’énergie au milieu extérieur :
la transformation est endothermique.
L’agitation des particules est plus grande, les liaisons entre les particules peuvent se rompre et le désordre augmente.
Exemples : la fusion, la vaporisation ou la sublimation. - Lorsque le corps se refroidit, la transformation est exothermique.
L’agitation des particules diminue, elles peuvent créer de nouvelles liaisons et l’ordre se fait.
Exemples : la solidification, la condensation et la liquéfaction.
B Énergie de changement d’état
B
- ΔE représente l'énergie acquise ou perdue lors d'un changement d'état. Elle provient d'un transfert thermique Q avec un autre système, d'où Q=ΔE.
- On en déduit : Q=m⋅L
avec :
Q la quantité d’énergie transférée en Joule (J) ;
m la masse du corps en kilogramme (kg) ;
L l'énergie massique de changement d’état en J·kg-1. - L est aussi appelée chaleur latente de changement d’état ou enthalpie de changement d’état.
Les limites de la modélisation
Les limites de la modélisation
-
Le modèle particulaire est une représentation simplifiée de la réalité.
- de représenter les trois principaux états physiques de la matière et de comprendre leurs propriétés ;
- de distinguer les notions de fusion et dissolution ;
- d’interpréter les effets d’un chauffage ou d’un refroidissement au niveau macroscopique.
- de comprendre que les énergies massiques de changement d’état dépendent de la pression et de la température ;
- de comprendre certains phénomènes, comme la surfusion de la glace.
Les molécules, atomes ou ions sont représentés par des sphères de couleur supposées rigides, insécables et indéformables.
Ce modèle permet :
Mais il ne permet pas :
Utilisation des cookies
Lors de votre navigation sur ce site, des cookies nécessaires au bon fonctionnement et exemptés de consentement sont déposés.