CHAPITRE 6
Stabilité des entités chimiques
- Plan
- Définitions
- En pratique
1 En quête de stabilité
1
A Les gaz nobles, des espèces chimiques
particulièrement stables
A
- À l’exception de l’atome d’hélium qui possède deux électrons sur sa couche externe, les autres atomes de gaz nobles ont tous huit électrons sur leur couche externe.
- La grande stabilité des gaz nobles est liée au nombre particulier
d’électrons qu’ils possèdent sur leur couche externe :
❯ soit deux électrons (duet d’électrons) pour l’atome He.
❯ soit huit électrons (octet d’électrons) pour les autres atomes (Ne, Ar).
B Des règles de stabilité
B
- Deux règles sont définies :
❯ la règle du duet : les atomes dont le numéro atomique est proche de celui de l’hélium Z= 2 ont tendance à adopter sa configuration à deux électrons (1s2)
❯ la règle de l’octet : les autres atomes ont tendance à adopter la configuration électronique externe du gaz noble le plus proche avec huit électrons (ns2np6) . - Les règles du duet et de l’octet permettent de justifier l'existence des ions monoatomiques.
2 Le modèle de Lewis
2
A Liaison covalente et doublets non liants
A
- La liaison covalente est une mise en commun de deux électrons de valence entre deux atomes. La liaison covalente est représentée par un tiret :

- Les électrons de valence d’un atome qui ne participent pas aux liaisons covalentes sont répartis en doublets d’électrons appelés doublets non liants.
Le doublet non liant est représenté par un tiret placé sur l’atome considéré :
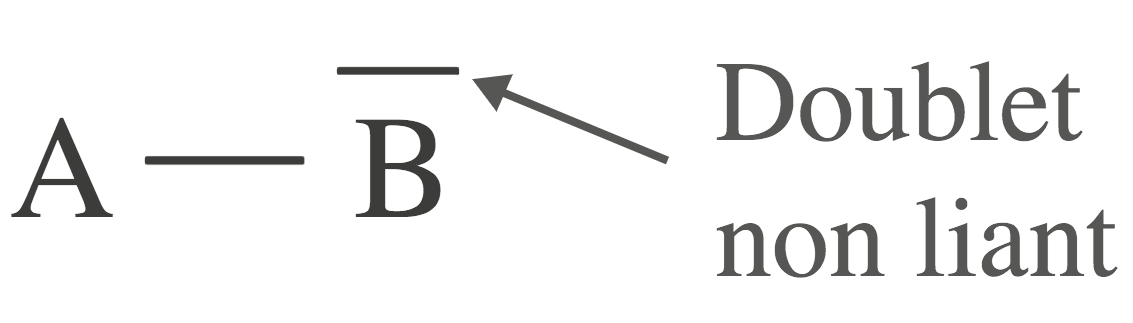
B Formule de Lewis et stabilité des molécules
B
- Chaque atome respecte soit la règle du duet, soit la règle de l’octet.
- Les formules de Lewis des molécules permettent de vérifier le respect de ces règles en comptabilisant les électrons des liaisons covalentes et des doublets non liants pour chaque atome de la molécule.
Les limites de la modélisation
Les limites de la modélisation
Le modèle de Lewis :
- permet de rendre compte de la stabilité des espèces chimiques comme les gaz nobles ;
- permet d'expliquer et prévoir la stabilité des ions monoatomiques et des atomes au sein des molécules ;
- est particulièrement pertinent pour les éléments chimiques dont le numéro atomique est inférieur à 20.
Mais il ne permet pas de :
- connaître la géométrie dans l’espace des molécules ;
- expliquer certaines propriétés chimiques observées.
Utilisation des cookies
Lors de votre navigation sur ce site, des cookies nécessaires au bon fonctionnement et exemptés de consentement sont déposés.

